Ionski kristali
Med ioni natrija in kloridnimi ioni nastane ionska vez. Ioni se med seboj privlačijo v vseh smereh, zato se jih med seboj veliko poveže. Struktura, ki nastane, je ionski kristal. Delci v kristalih so razporejeni na urejen in periodičen način.
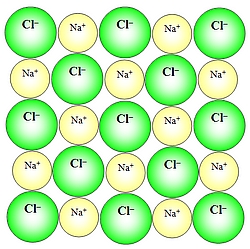
Submikroskopski prerez kristala natrijevega klorida |
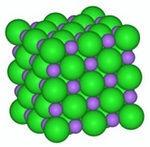
Razporeditev natrijevih in kloridnih ionov v kristalu NaCl Vir: www.kanescience.com [2. 9. 2008] |
Plasti ionov potekajo v vseh smereh. Okrog enega natrijevega iona je 6 kloridnih ionov in obratno. Spojina natrijevega klorida je električno nevtralna, to pomeni, da je število kationov enako številu anionov. Razmerje med anioni in kationi nam prikazuje empirična formula.
NaCl → empirična formula natrijevega klorida
S kemijskim zapisom lahko formulo NaCl razložimo takole:
| Na → Na+ + 1e− | 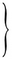
|
Na+ + Cl− → NaCl |
| Cl + 1e− → Cl− |
Na2O → empirična formula dinatrijevega oksida, iz katere je razvidno, da je v kristalu 2-krat več natrijevih kot oksidnih ionov. Zakaj? Natrijevi ioni imajo en pozitiven naboj, oksidni pa dva negativna. Da nastane nevtralna spojina, je potrebno enako število pozitivnih in negativnih nabojev.
| 2Na → 2Na+ + 2 · (1e−) | 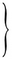 |
2Na+ + O2− → Na2O |
| O + 2e− → O2− |
Opomba: Pojem empirična formula si ti ni potrebno zapomniti. Z njim se boš srečal v srednji šoli.
Domov | 1. sklop | 2. sklop | 3. sklop | 4. sklop | 5. sklop | 6. sklop | 7. sklop |
OŠ Belokranjskega odreda Semič

