Zakaj relativna atomska masa elementa ni celo število?
Relativna atomska masa je izračunano povprečje relativnih atomskih mas izotopov elementa. Pri izračunu upoštevajo delež določenih izotopov, v kakršnem so prisotni v naravi.
Nekaj primerov elementov, ki imajo izotope:
-
element uran ima 99,3 % 238U, le malo (O,7 %) pa je izotopa 235U. V periodnem sistemu je ob simbolu urana zapisano izračunano povprečje obeh izotopov v naravi, in sicer 238,03U.
- zelo veliko znanih izotopov imata elementa cezij, in to 32, ter francij, ki jih ima 33. Edini v naravi obstojen cezijev izotop je izotop 133Cs, pri franciju pa 223Fr, ki je obstojen 22 minut.
Element klor, ki ima vrstno število 17, ima v naravi znana dva izotopa. 75,4 % klorovih atomov v naravi predstavlja izotop, ki ima v svojih jedrih 18 nevtronov, 24,6 % pa je izotopa z 20 nevtroni. Zapiši ob simbolu klora oba izotopa z vrstnim in masnim številom.
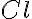 |
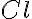 |
|||
Domov | 1. sklop | 2. sklop | 3. sklop | 4. sklop | 5. sklop | 6. sklop | 7. sklop |
OŠ Belokranjskega odreda Semič