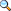Rjavenje
Železo in jeklo sta izpostavljena rjavenju, ki ga imenujemo korozija. Ta poteka zelo hitro, če je železo ali jeklo v stiku s kisikom iz zraka in z vodo.
 |
 |
| Delno zarjavele jeklene mreže in šipke | |
Hitrost rjavenja je večja tudi v prisotnosti nekaterih soli (NaCl).
Poenostavljeno reakcijo rjavenja lahko zapišemo:
| 4Fe |
+ | 3O2 | + | nH2O | → |
2Fe2O3 · nH2O |
| železo | + |
kisik |
+ |
voda |
→ |
železov oksid (rja) |
Zaradi rje postanejo predmeti iz železa in jekla krhki in neuporabni ter s časoma razpadejo.
Zaščita pred rjavenjem:
- barvanje → avtomobili, ograje, mostovi ...,
- oljni premazi → verige, orodja ...,
- umetne mase (plastificiranje) → gospodinjski aparati, vrtne garniture ...,
- uporaba manj reaktivne kovine → npr. kositer za pločevinke,
-
uporaba bolj reaktivne kovine → npr. cink za
avtomobilska ogrodja, vedra oz. magnezij za ladijske trupe.

Večina pločevink je iz jekla, ki ga zaščitijo s tanko plastjo kositra.
Barvni premazi za zaščito kovin.
Železo in jeklo se lahko reciklira, zato je zelo pomembno načrtno zbiranje starega železa, ki ga lahko ponovno uporabimo, s tem pa varujemo naravo.

Staro železo pripravljeno za reciklažo.
Če te zanima, si lahko več o postopku predelave starega železa ogledaš na spletnem naslovu.
Za vajo reši delovni list: Železo, jeklo, rjavenje
Domov | 1. sklop | 2. sklop | 3. sklop | 4. sklop | 5. sklop | 6. sklop | 7. sklop |
OŠ Belokranjskega odreda Semič